Développement d'auto-immunité et d'Inflammation au niveau de l'intestin
Dr. Serrano Maëlle
Dermatologue à Dillingen, Saare, De
Quand on parle du Corps, et de la Santé, ce n’est pas seulement blanc ou noir, mais plutôt toute une variation de gris intermédiaires. Nous savons tous que l’environnement interagit avec notre corps. L’exemple le plus clair de cette interaction est celui de l’allergie. Les organes qui sont le plus souvent atteints d’allergie sont ceux qui sont le plus en contact avec le monde extérieur : la peau, les poumons, et le tube digestif.
Ces organes sont habituellement une barrière entre nous, et le monde extérieur. Beaucoup de choses peuvent rompre ces barrières : la fumée endommage les poumons, les substances caustiques endommagent la peau, et certains produits alimentaires endommagent l’intestin.
Quand nous avons entendu parler des modifications génétiques occasionnées sur le maïs, pour qu’il puisse résister à un insecte spécifique, ou pour qu’il soit plus rentable, cela a été un scandale. Cependant, nous n’avons aucun problème à continuer à consommer du blé, qui possède actuellement 14 chromosomes de plus que le blé original (il est passé de 7 à 21 chromosomes). La seule différence entre ces deux modifications alimentaires est que le maïs a été modifié de manière artificielle dans un laboratoire, et que le Blé a été modifié de manière artificielle par croisement répété de souches de blé, jusqu’à obtention de la graine désirée par l’industrie agricole. Ceci étant dit, ce n’est pas parce que quelque chose a été obtenu à l’extérieur d’un laboratoire que les produits obtenus peuvent être considérés comme naturels.
Par le biais de l’évolution, l’Homme s’est habitué au blé original. Il a pu développer toute la machinerie enzymatique nécessaire à la digestion du blé, et son absorption nutritionnelle. Actuellement, la société agricole ne voyant que le gain économique, a tellement modifié les souches de blé d’origine, qu’il contient maintenant 21 chromosomes, au lieu des 7 chromosomes initiaux. Ces modifications ont été occasionnées de manière si rapide, que l’Homme n’a pas eu le temps de s’approprier ces modifications génétiques, pour fabriquer les enzymes nécessaires à la digestion des nouvelles protéines rencontrées. C’est pour cela que certaines des nouvelles protéines, trop peu semblables aux protéines ancestrales ne peuvent être digérées correctement, et endommagent notre barrière intestinale.
Un thème qui se doit d’être abordé lorsque l’on parle de l’intestin est celui de l’écosystème intestinal. L’intestin est l’organe qui est le plus en contact avec des bactéries. En effet, l’intestin abrite environ 1014 bactéries dans seulement 1 gramme de son contenu ! C’est la raison pour laquelle le tube digestif est le plus grand composant du système immunitaire, et le plus complexe.
Donc, comme nous l’avons mentionné précédemment, la muqueuse intestinale est une barrière entre notre milieu intérieur et le monde extérieur, contenant non seulement l’alimentation, mais aussi les diverses bactéries du microbiome intestinal, bactéries pathogènes, et toxines. Habituellement, les cellules de l’intestin sont quasiment imperméables, car elles possèdent des jonctions serrées intercellulaires.
Ces nouvelles protéines entrent en contact avec nos cellules, sans pouvoir être dégradées par les enzymes qu’elles rencontrent. Elles vont donc être identifies comme étrangères par les cellules (tout comme pourrait le faire une bactérie), ce qui va entrainer une réaction en chaine dans la cellule de la muqueuse intestinale. Cette réaction aura comme effet une perte de l’étanchéité de la barrière intestinale : l’hyperperméabilité intestinale.
C’est à ce moment qu’entre en jeu notre système immunitaire. Quand quelque chose rentre dans le sang (à ce moment, il s’appellera un antigène), les leaders du système immunitaire (les Globules Blancs) vont tenter de le reconnaitre. Si les Globules Blancs ne reconnaissent pas l’antigène, ils vont alors produire leurs propres molécules qui sont les Cytokines. Ces Cytokines vont alors se fixer sur un récepteur nommé HLAII, et elles activeront le reste du système immunitaire pour signaler la présence d’un antigène inconnu.
Certaines personnes peuvent avoir ce qu’on appelle des prédispositions génétiques, qui dans ce cas précis pourrait être une présence beaucoup plus importante de ces récepteurs HLAII sur leurs cellules que les autres personnes. Suite à cette prédisposition, le système immunitaire sera beaucoup plus facilement et rapidement activé, et son activation sera d’une ampleur beaucoup plus grande que pour les personnes sans cette surexpression génétique du HLAII. Ceci est la base de toutes les maladies auto-immunes, comme le Lupus, la polyarthrite rhumatoïde, la sclérose en plaques et beaucoup d’autres.
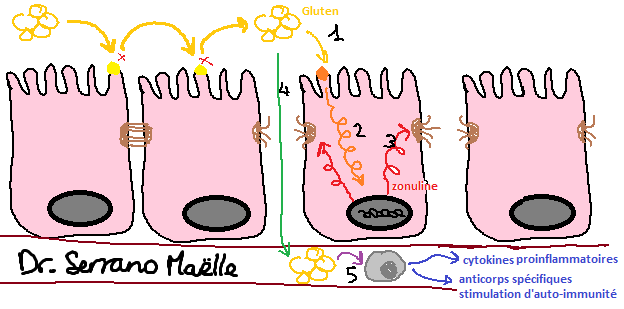
Alors, comment est-ce que ça fonctionne ? Nous mangeons quelque chose que nous ne pouvons pas digérer (comme le Lactose, ou le Gluten par exemple), car nous ne possédons pas l’enzyme appropriée pour effectuer la digestion de ces protéines. Ces protéines que nous ne pouvons pas dégrader vont activer nos cellules intestinales. Cette activation envoie un signal au noyau de la cellule, et notre ADN va produire une protéine qui va rompre les jonctions entre les cellules intestinales. L’hyperperméabilité intestinale fait en sorte que toutes les Bactéries, Aliments non digérables, et Toxines puissent entrer dans le sang pour être analysés par notre système immunitaire, qui pourra alors réagir en conséquence. A partir de ce moment, il y a beaucoup d’effets indésirables qui pourront se produire en même temps.
Tout d’abord, localement, il y aura une inflammation de l’intestin, car la muqueuse intestinale s’est altérée. Tout l’écosystème intestinal est chamboulé, ce qui nous fait entrer dans un cercle vicieux produisant encore plus d’inflammation à ce niveau. Le corps a normalement la capacité de se protéger des infections en limitant la composante inflammatoire produite par les bactéries. L’hyperperméabilité intestinale va déséquilibrer l’écosystème bactérien intestinal, empêchant les mesures Immunitaires protectrices normales de l’intestin. Cette conséquence à elle seule aura de nombreux effets néfastes au niveau de la paroi intestinale, avec entre autres augmentation de la composante inflammatoire, pouvant chez certaines personnes entrainer des pathologies inflammatoires intestinales comme la maladie de Crohn par exemple.
Comme le système immunitaire est activé, il y aura aussi des conséquences à distance de l’intestin, des effets généraux, qui dépendent de la quantité d’antigènes qui pénètrent dans le sang, et de la durée d’exposition à ces antigènes.
Si quelqu’un mange trop souvent un aliment qu’il ne peut pas digérer correctement, il pourra alors développer une hypersensibilité à cet aliment, autrement dit une intolérance alimentaire. La perméabilité intestinale sera alors d’autant plus présente. Ces personnes pourront aussi plus facilement développer des infections et inflammations généralisées dû au passage de bactéries et toxines dans le sang.
Si quelqu’un a déjà une pathologie immunitaire, la présence constante d’antigènes alimentaires et de cytokines pro-inflammatoires dans le sang maintiendra le système immunitaire en activité, et la maladie restera active alors que normalement le processus s’estomperait naturellement.
La situation présente est alors un cercle vicieux, car nous avons toujours les mêmes problèmes, et toujours la même alimentation sans jamais faire le lien entre les deux. Nous pouvons changer notre alimentation, et ainsi laisser le temps à notre muqueuse intestinale de cesser les phénomènes inflammatoires, et de redevenir saine et normale. Pour accélérer la guérison intestinale, la prise de Probiotiques qui rééquilibrent l’écosystème a déjà démontré de nettes améliorations. Ensuite, le régime sans gluten est certes compliqué à mettre en place initialement, mais une fois que l’on prend nos repères, cela devient une habitude, et les difficultés suites à ce régime disparaissent.
Seulement de cette manière pourrons nous briser ce cercle vicieux pro-inflammatoire, et diminuer par la base les maladies auto-immunitaires qui sont actuellement en augmentation constante.
Bibliographie
• Bengmark, S. (2013). Gut microbiota, immune development and function. Pharmacological Research, 69(1), 87-113.
• Berthou, A. (2014). Faut-il éviter le gluten? Les protéines de lait? Quels sont les rôles de l’écosystème intestinal sur la santé? Articles Santé, Au quotidien, Conseils en santé et nutrition au quotidien, Les conseils sur la nutrition, la micronutrition et le sport. Retrieved from http://www.sante-et-nutrition.com/gluten-lait-intestin/
• Catassi, C. (2015). Gluten sensitivity. Annals of Nutrition and Metabolism, 67(Suppl. 2), 15-26.
• Catassi, C., Elli, L., Bonaz, B., Bouma, G., Carroccio, A., Castillejo, G., . . . Dolinsek, J. (2015). Diagnosis of non-celiac gluten sensitivity (NCGS): the Salerno experts’ criteria. Nutrients, 7(6), 4966-4977.
• Cobrin, G. M., & Abreu, M. T. (2005). Defects in mucosal immunity leading to Crohn's disease. Immunological reviews, 206(1), 277-295.
• COLARELLI, M. (2010). LES PROBIOTIQUES, DU CONSEIL OFFICINAL A LA PRISE EN CHARGE MICRONUTRITIONELLE. (Diplôme d'Etat de Docteur en Pharmacie), UNIVERSITE HENRI POINCARE - NANCY 1. Retrieved from http://docnum.univ-lorraine.fr/public/SCDPHA_T_2010_COLARELLI_MAILYS.pdf
• El-Chammas, K., & Danner, E. (2011). Gluten-free diet in nonceliac disease. Nutrition in Clinical Practice, 26(3), 294-299. doi:https://doi.org/10.1177/0884533611405538
• Fasano, A. (2015). A Clinical Conversation: Celiac Disease and Gluten-Related Disorders: Integrative Clinical Approaches. Alternative and Complementary Therapies, 21(1), 18-21.
• Hadjivassiliou, M., Sanders, D. S., Grünewald, R. A., Woodroofe, N., Boscolo, S., & Aeschlimann, D. (2010). Gluten sensitivity: from gut to brain. The Lancet Neurology, 9(3), 318-330.
• Kajander, K., Hatakka, K., Poussa, T., Färkkilä, M., & Korpela, R. (2005). A probiotic mixture alleviates symptoms in irritable bowel syndrome patients: a controlled 6‐month intervention. Alimentary pharmacology & therapeutics, 22(5), 387-394.
• Koboziev, I., Webb, C. R., Furr, K. L., & Grisham, M. B. (2014). Role of the enteric microbiota in intestinal homeostasis and inflammation. Free Radical Biology and Medicine, 68, 122-133.
• Lerner, A., Ramesh, A., & Matthias, T. (2017). Are Non-Celiac Autoimmune Diseases Responsive to Gluten-Free Diet? International Journal, 5(4), 164-167. doi:10.12691/ijcd-5-4-6
• Lozupone, C. A., Stombaugh, J. I., Gordon, J. I., Jansson, J. K., & Knight, R. (2012). Diversity, stability and resilience of the human gut microbiota. Nature, 489(7415), 220.
• Luckey, T. (1972). Introduction to intestinal microecology. Am J Clin Nutr, 25(12), 1292-1294.
• Martínez, M., Domínguez, J., Alegre, A., & Martínez-Raga, J. (2010). Gluten as a precipitating factor of autoimmune diseases other than celiac disease. The Proceedings of the Nutrition Society, 69(OCE3).
• Rostami, K., Bold, J., Parr, A., & Johnson, M. W. (2017). Gluten-Free Diet Indications, Safety, Quality, Labels, and Challenges: Multidisciplinary Digital Publishing Institute.
• San Mauro, M. I., Garicano, V. E., & Collado, Y. L. (2014). Is gluten the great etiopathogenic agent of disease in the XXI century? Nutr Hosp. doi:10.3305/nh.2014.30.6.7866
• Sartor, R. B. (2008). Microbial influences in inflammatory bowel diseases. Gastroenterology, 134(2), 577-594.
• Schnedl, W. J., Lackner, S., Enko, D., Schenk, M., Mangge, H., & Holasek, S. J. (2017). Non-celiac gluten sensitivity: people without celiac disease avoiding gluten—is it due to histamine intolerance? Inflammation Research, 1-6. doi:https://doi.org/10.1007/s00011-017-1117-4
• Seignalet, J. (2004). Alimentacion, la tercera medicina: Rba Libros Sa.
• Seignalet, A. J. La méthode Seignalet. Retrieved from http://www.seignalet.fr/fr/le-regime-seignalet/comprendre-le-regime/la-methode-seignalet.html
• Volta, U., Caio, G., Karunaratne, T. B., Alaedini, A., & De Giorgio, R. (2017). Non-coeliac gluten/wheat sensitivity: advances in knowledge and relevant questions. Expert review of gastroenterology & hepatology, 11(1), 9-18. doi:https://doi.org/10.1080/17474124.2017.1260003
